👍💢¿Qué son las Fuerzas intramoleculares?
Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares, es decir, enlaces iónicos y covalentes principalmente. Por lo tanto, son estas las fuerzas que se deben vencer para que se produzca un cambio químico. Además, son las encargadas de determinar las propiedades químicas de las sustancias.
🔔⛔Hay que tener en cuenta algo importante
😎💬¿Qué es un enlace químico?
Es la fuerza que une a los átomos para formar compuestos químicos. Esta unión le transmite estabilidad al compuesto resultante.
✔Tipos de enlaces químicos
Enlace Covalente: es la fuerza que une a dos átomos no metálicos y de cargas electronegativas semejantes para formar una molécula. Lo fundamental de esta unión es el hecho de que los átomos comparten pares de electrones en su capa más externa (capa de valencia) para lograr la estabilidad de la molécula que se ha generado con el enlace. Por otra parte, cuando los elementos tienden a lograr una configuración estable, se le conoce como la regla del octeto y es fundamental para los enlaces iónicos y covalentes.
Explicación regla del octeto.
Según sea la capacidad de los átomos para atraer electrones, los enlaces covalentes pueden ser polares o no polares. También pueden ser simples dobles o triples, conforme a la cantidad de electrones que comparten.
👾👻Tipos de enlaces covalentes
Se clasifican en función de la electronegatividad de los átomos del enlace y del número de electrones compartidos entre ellos.
🔍 Video 2. Introducción enlaces covalentes.
💥Enlace covalente polar:
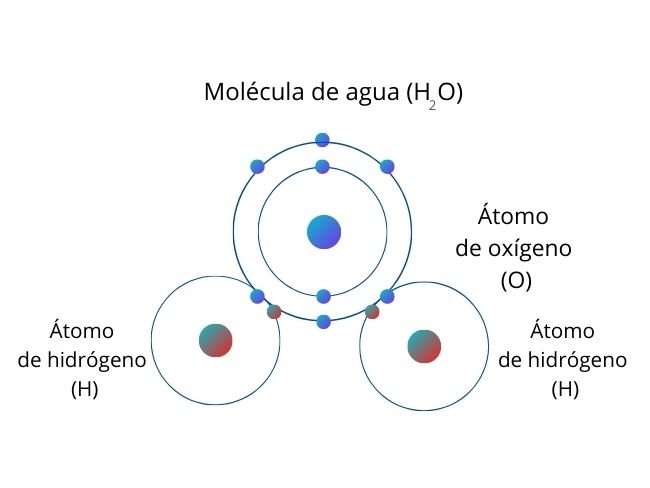
Cuando hay un átomo que atrae a los electrones con mayor intensidad, se genera una mayor concentración de electrones en esa parte de la molécula. A este proceso se le conoce como polaridad. La parte de la molécula donde se concentran los electrones tiene una carga parcial negativa, mientras la otra región de la molécula tiene una carga parcial positiva.
Representación del proceso con la molécula de Agua
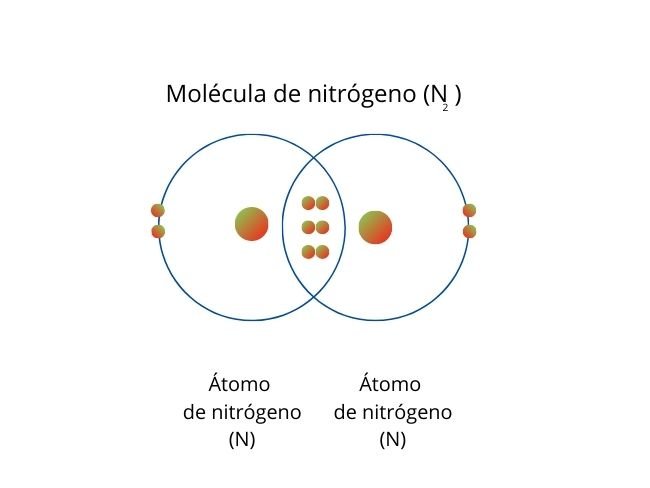
💢Enlace covalente no polar:
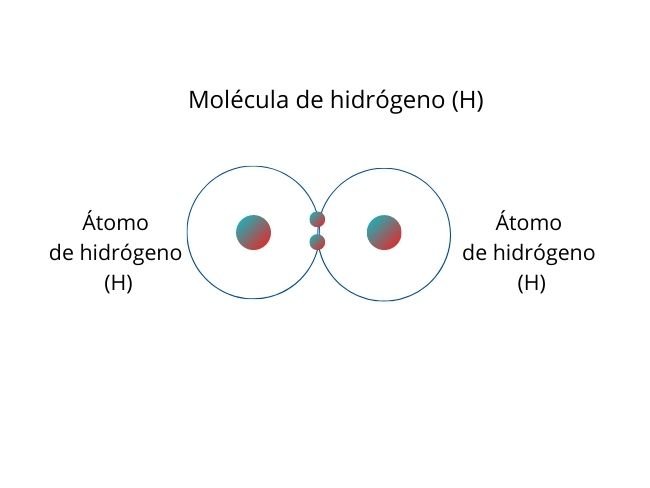
Ocurre cuando los pares de electrones se comparten entre átomos. Además, tienen una electronegatividad igual o similar. Por lo cual, esto favorece la distribución equitativa de electrones.
Representación del proceso con el Hidrogeno Molecular
💣Enlace covalente simple:
Ocurre cuando cada átomo comparte un electrón para completar el par de electrones del enlace.
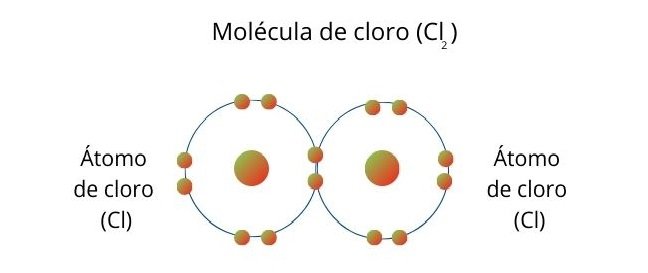
Representación del proceso con el Cloro Molecular
Una molécula de cloro se forma cuando los átomos comparten un electrón para completar ocho electrones en su capa de valencia cada uno.
👽Enlace covalente doble:
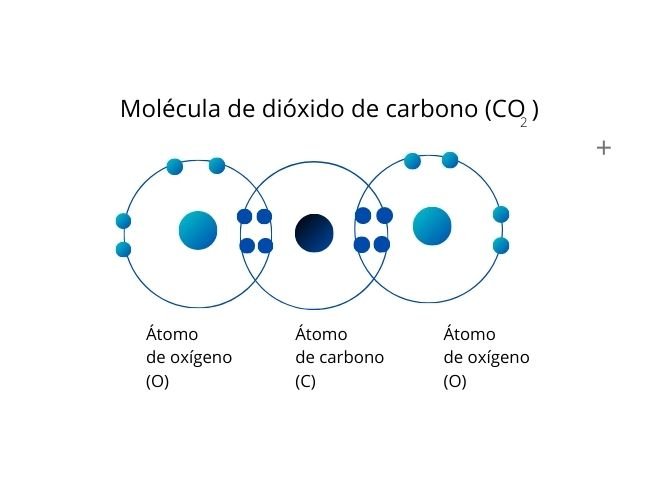
Se genera cuando se comparten dos pares de electrones entre dos átomos, lo cual genera un total de cuatro electrones compartidos.
Representación del proceso con la Molécula de Dióxido de carbono.
💥💫Enlace Iónico
Para más ejemplos y diferencias entre el enlace covalente y enlace iónico puedes ingresar a:
👉20 Ejemplos de enlaces iónicos | Definición, Diferencias y Propiedades (wikiejemplos.com)
PONLO EN PRÁCTICA
En el siguiente link puedes hacer varias actividades relacionadas con esta temática:
Características de los enlaces | Educaplus
Referencias:
Páginas web
Enlace iónico: qué es, características, propiedades y ejemplos - Significados
Enlace Químico - Concepto, tipos de enlaces y ejemplos
Artículos académicos:
4.-ENLACE-QUÍMICO.-LIBRO-PRINCIPAL.pdf (unaquimicaparatodos.com)
Imágenes
https://image.slidesharecdn.com/enlacequimicoylaregladelocteto-130119221747-phpapp01/95/enlace-quimico-y-la-regla-del-octeto-10-638.jpg?cb=1358633952
https://s1.significados.com/foto/enlace-polar.jpg
https://s1.significados.com/foto/enlace-no-polar.jpg
https://s1.significados.com/foto/enlace-simple-a4.jpg
https://s1.significados.com/foto/enlace-doble.jpg
https://s1.significados.com/foto/enlace-triple-cb.jpg
https://curiosoando.com/wp-content/uploads/2018/06/enlace-ionico-NaCl.png




No hay comentarios.:
Publicar un comentario