👾👍Las TICs proporcionan múltiples herramientas para la enseñanza en la educación científica:
Alfabetización cientifica
miércoles, 27 de octubre de 2021
¿En que consisten las TICs
martes, 26 de octubre de 2021
¿Fuerzas intramoleculares? ¿Enlace covalente y enlace iónico?
👍💢¿Qué son las Fuerzas intramoleculares?
Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares, es decir, enlaces iónicos y covalentes principalmente. Por lo tanto, son estas las fuerzas que se deben vencer para que se produzca un cambio químico. Además, son las encargadas de determinar las propiedades químicas de las sustancias.
🔔⛔Hay que tener en cuenta algo importante
😎💬¿Qué es un enlace químico?
Es la fuerza que une a los átomos para formar compuestos químicos. Esta unión le transmite estabilidad al compuesto resultante.
✔Tipos de enlaces químicos
Enlace Covalente: es la fuerza que une a dos átomos no metálicos y de cargas electronegativas semejantes para formar una molécula. Lo fundamental de esta unión es el hecho de que los átomos comparten pares de electrones en su capa más externa (capa de valencia) para lograr la estabilidad de la molécula que se ha generado con el enlace. Por otra parte, cuando los elementos tienden a lograr una configuración estable, se le conoce como la regla del octeto y es fundamental para los enlaces iónicos y covalentes.
Explicación regla del octeto.
Según sea la capacidad de los átomos para atraer electrones, los enlaces covalentes pueden ser polares o no polares. También pueden ser simples dobles o triples, conforme a la cantidad de electrones que comparten.
👾👻Tipos de enlaces covalentes
Se clasifican en función de la electronegatividad de los átomos del enlace y del número de electrones compartidos entre ellos.
🔍 Video 2. Introducción enlaces covalentes.
💥Enlace covalente polar:
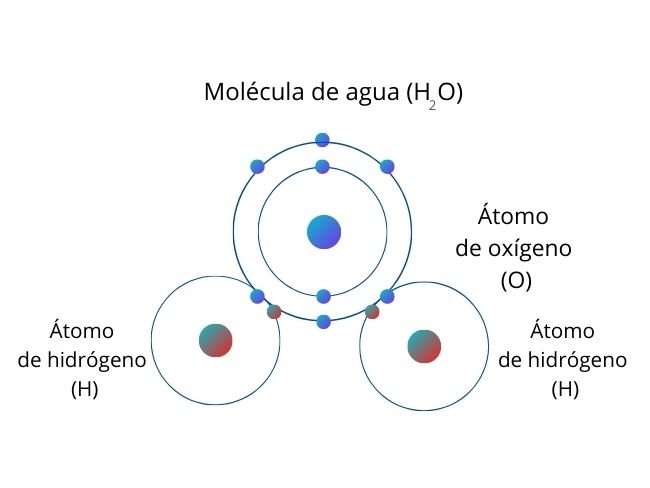
Cuando hay un átomo que atrae a los electrones con mayor intensidad, se genera una mayor concentración de electrones en esa parte de la molécula. A este proceso se le conoce como polaridad. La parte de la molécula donde se concentran los electrones tiene una carga parcial negativa, mientras la otra región de la molécula tiene una carga parcial positiva.
Representación del proceso con la molécula de Agua
💢Enlace covalente no polar:
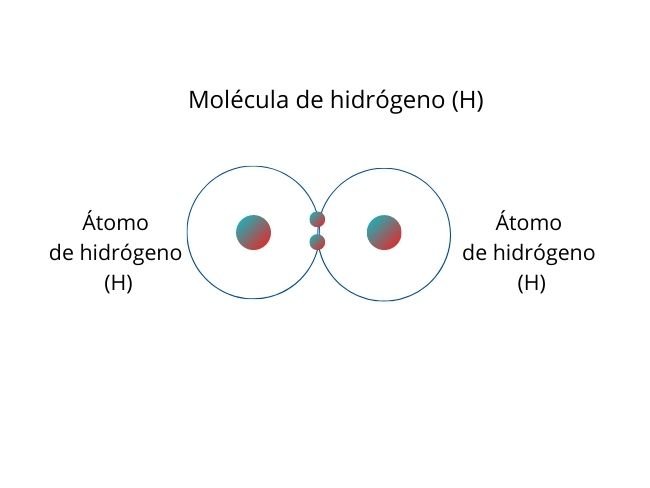
Ocurre cuando los pares de electrones se comparten entre átomos. Además, tienen una electronegatividad igual o similar. Por lo cual, esto favorece la distribución equitativa de electrones.
Representación del proceso con el Hidrogeno Molecular
💣Enlace covalente simple:
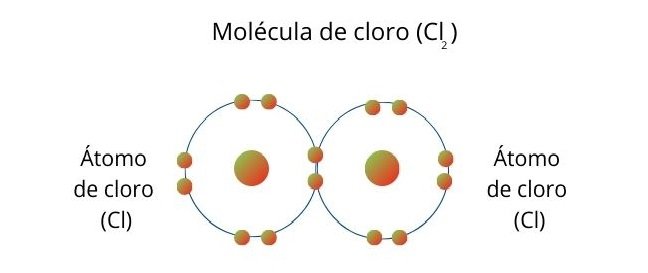
Ocurre cuando cada átomo comparte un electrón para completar el par de electrones del enlace.
Representación del proceso con el Cloro Molecular
Una molécula de cloro se forma cuando los átomos comparten un electrón para completar ocho electrones en su capa de valencia cada uno.
👽Enlace covalente doble:
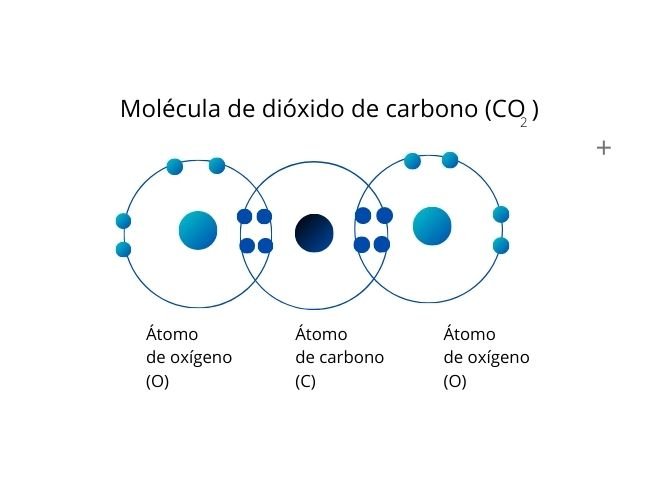
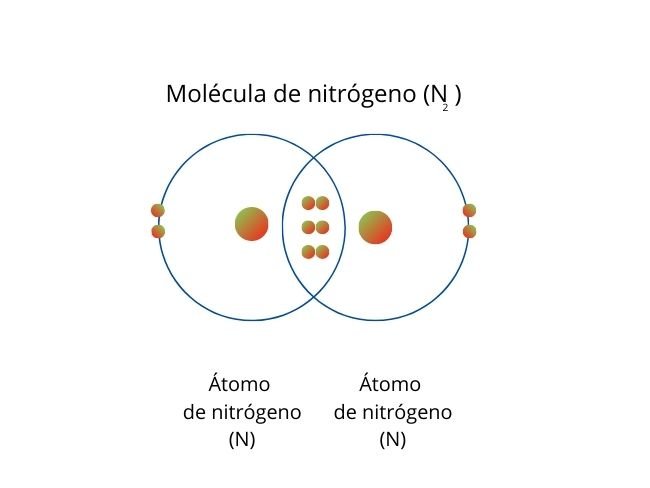
Se genera cuando se comparten dos pares de electrones entre dos átomos, lo cual genera un total de cuatro electrones compartidos.
Representación del proceso con la Molécula de Dióxido de carbono.
💥💫Enlace Iónico
Para más ejemplos y diferencias entre el enlace covalente y enlace iónico puedes ingresar a:
👉20 Ejemplos de enlaces iónicos | Definición, Diferencias y Propiedades (wikiejemplos.com)
PONLO EN PRÁCTICA
En el siguiente link puedes hacer varias actividades relacionadas con esta temática:
Características de los enlaces | Educaplus
Referencias:
Páginas web
Enlace iónico: qué es, características, propiedades y ejemplos - Significados
Enlace Químico - Concepto, tipos de enlaces y ejemplos
Artículos académicos:
4.-ENLACE-QUÍMICO.-LIBRO-PRINCIPAL.pdf (unaquimicaparatodos.com)
Imágenes
https://image.slidesharecdn.com/enlacequimicoylaregladelocteto-130119221747-phpapp01/95/enlace-quimico-y-la-regla-del-octeto-10-638.jpg?cb=1358633952
https://s1.significados.com/foto/enlace-polar.jpg
https://s1.significados.com/foto/enlace-no-polar.jpg
https://s1.significados.com/foto/enlace-simple-a4.jpg
https://s1.significados.com/foto/enlace-doble.jpg
https://s1.significados.com/foto/enlace-triple-cb.jpg
https://curiosoando.com/wp-content/uploads/2018/06/enlace-ionico-NaCl.png
¿Qué es una reacción química? ¿Productos y reactivos?
🙋👉 Las reacciones químicas o también conocidas como cambios químicos...
Son procesos en los que una o mas sustancias químicas (llamadas reactivos) se transforman en otras con propiedades diferentes (llamadas productos).
Ejemplos de reacciones químicas en la vida cotidiana:
🔎💡Cada vez que enciendes una cerilla, prendes una parrilla o quemas una vela ves una reacción de combustión. La combustión es un cambio químico de estado en la que un combustible se combina con el oxigeno, allí se desprende luz y calor.
Combustión de la cerilla.
👀💥 Cuando se combina un ácido (por ejemplo vinagre, jugo de limón, ácido sulfúrico, o ácido muriático) con una base (por ejemplo bicarbonato se sodio, jabón, amoniaco, o acetona) se esta realizando una reacción acido- base, en este sentido, lo que se logra es neutralizar el ácido y la base para producir una sal y agua, en algunas ocasiones también se desprende un gas.
Reacción vinagre y bicarbonato.
Para ver más tipos de reacciones en la vida cotidiana puedes ingresar a: 🥇 Ejemplos de reacciones químicas en la vida cotidiana - Ciencia de Hoy
🔔🔍¿Qué son los reactivos y los productos?
✔Los reactivos son las sustancias que existen antes del cambio químico.
✔los productos son las nuevas sustancias que se forman durante el cambio químico.
Reacción química para producir Amoníaco.
🔎 Video 1. Explicación detallada de las reacciones químicas.
PONLO EN PRÁCTICA
Para hacer actividades acerca de lo que vimos anteriormente puedes ingresar al siguiente link:
Reaccionantes, Productos y Sobrantes (colorado.edu)
Referencias:
Páginas web:
Que es una Reacción Química - Corporativo Quimico Global
Libros
REACCIONES QUÍMICAS (xtec.cat)
Imágenes
https://www.promam.es/wp-content/uploads/2017/12/combustion.jpg
https://th.bing.com/th/id/R.36b7306fa1b59cacd7c1d0c977a41379?rik=sIt%2fqZnq%2ba2fSg&riu=http%3a%2f%2fwww.portalhuarpe.com.ar%2fMedhime20%2fTalleres%2fTALLERES+SECUNDARIOS+UNSJ%2fCENTRAL%2f07Reacciones+Quimicas%2fimages%2ffoto2.png&ehk=rQ7Z89rLZFD8I7RBZ4z0MU0XT9n%2bVEANXjq4%2b3qDrO4%3d&risl=&pid=ImgRaw&r=0
https://th.bing.com/th/id/R.7c8743bcf3fefed6dd2241cbd8bba049?rik=fxqGuL0aes23dQ&riu=http%3a%2f%2f1.bp.blogspot.com%2f_59EYRCCNSjI%2fTGiWTRUwoGI%2fAAAAAAAAADM%2fAlvc6aRdBn0%2fs1600%2fPresentaci%c3%b3n1.jpg&ehk=chmDPNomI%2fcV5UgWAN3G%2fgRbBTcI7EqDMjS7rPCUApk%3d&risl=&pid=ImgRaw&r=0&sres=1&sresct=1
miércoles, 20 de octubre de 2021
¿En qué consisten las moléculas?
👀👧👨¿Qué son las moléculas?


Ejemplos en la vida cotidiana...
😀👀Moléculas de la vida En primer lugar, encontraremos la molécula de ADN: es una macromolécula base de la herencia, es decir, el ADN son siglas para el ácido desoxirribonucleico y tiene como función principal el almacenamiento de toda la información necesaria para la expresión de determinadas características, en segmentos denominados genes o empaquetada en cromosomas.
Estructura del ADN.👲👉La molécula de H2O (Agua): el agua es incolora, inodora y no tiene un sabor específico, su importancia radica en que participa en casi la totalidad de procesos químicos que suceden en nuestro entorno, no solo en organismos vivos sino también en los procesos llevados a cabo por los laboratorios.
💦💧En el siguiente video verás más detalladamente las propiedades de esta molécula tan indispensable...
💥🌱La celulosa: a pesar de su gran peso molecular, es sorprendentemente una molécula sencilla, que está formada solamente por moléculas del glucosa. La glucosa es un tipo de azúcar presente en la miel y frutas en el caso de las plantas, allí se produce a partir del dióxido de carbono y luz solar, a través del proceso de fotosíntesis.
Estructura Química de la celulosa Celulosa de los árboles.
PONLO EN PRÁCTICA
Para que puedas profundizar sobre lo que vimos anteriormente puedes ingresar a los siguientes links:
Referencias:
PONLO EN PRÁCTICA
Para que puedas profundizar sobre lo que vimos anteriormente puedes ingresar a los siguientes links: